При виконанні завдань щодо можливого застосування наночастинок срібла (НЧС) у медичних моделях було проведено попередній цикл робіт спільно з лабораторією імунології НДІ ім. акад. В.П. Філатова для вивчення оптичних властивостей крові та впливу інстиляції НЧС на формені елементи крові. Свіжий забір крові здорового пацієнта містився у кювету для спектрального аналізу з використанням спектрофотометра СФ 26. Спектр поглинання представлений на рис. 1.
Рис. 1 Спектр поглинання крові здорової людини.
У представленому спектрі поглинання крові визначається характерний максимум на довжині хвилі λ = 520 нм (Hb02, оксигемоглобін) і з довжиною хвилі λ = 560 нм (Hb Fetal фетального гемоглобіну), що
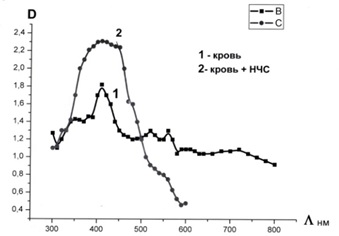
свідчить про те, що ми працюємо з нативною кровʼю здорової людини. Далі в кювету з кровʼю закапувався колоідний розчин наночастинок срібла з розміром 30 нм при відношенні обʼєму крові та розчину наночастинок срібла 1:12. Вимірювався спектр поглинання такого зразка представлен на Рис. 2.
Рис. 2. Спектри поглинання зразка крові: крива (1) та зразка крові з НЧС крива (2).
З рисунка видно, що спектр поглинання крові має максимум в ультрафіолетовій області, при цьому використовуване нами колоїдне срібло виявляє поверхневий плазмонний резонанс (ППР) у районі 420 нм., що відповідає розміру наночастинки срібла 30 нм. Додавання срібла в кров (крива 2) призводить до помітного розширення смуги діапазону поглинання, що може бути викликане наявністю плазмонного резонансу.
Для визначення можливого впливу НЧ срібла, активованих плазмонним резонансом на імунокомпетентні клітини крові, використовувались стандартні методики [1] приготування клітин крові для імунного аналізу в наступній послідовності:
1. Розкапувається кров по лунках з дистильованою водою для лізису еритроцитів.
2. Для збереження лімфоцитів від загибелі додається розчин Хенкса 10-кратної концентрації.
3. Центрифугується 10 хв. при 800 об.хв.
4. Знімається надосадок (1/2) рідини з лунки.
5. Вміст, що залишився, розкапується в ПЛР серологічний планшет.
6. Інкубують у термостаті на 30 хв. при 37о С.
7. Для визначення реакції розеткоутворення та фагоцитозу у лунку додають 0,05 мл. 01% суспензії еритроцитів барана.
8. Центрифугується 7 хв. при 700 об.хв.
9. Опромінюються лунки серологічного планшету з вмістом ультрафіолетового світла довжиною хвилі 420 нм. та потужністю опромінення 0,6 ват/см2 з експозицією в 30 хвилин.
10. Після опромінювання вміст лунок виливається на предметне скло, сушиться метанолом і готуються мазки,
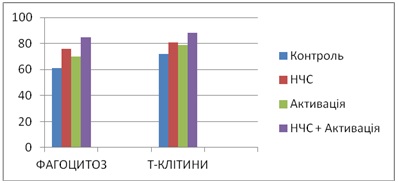
11.Визначається фагоцитарна активність нейтрофілів та стандартний тест з визначення чисельності та функціональної активності Т-лімфоцитів щодо реакції спонтанного розеткоутворення. Отримані результати наведено на діаграмі.
Рис. 3. Результати експериментів
З представлених результатів видно, що поєднана дія НЧС і освітлення УФ опромінюванням, що визиває ППР, призводить до збільшення фагоцитарної активності нейтрофілів (до 37%) проти контроля. За стандартним тестом розеткоутворення отримано збільшення активності та числа Т-лімфоцитів під впливом НЧ срібла, та при одночасному впливі НЧ срібла, активованих ППР (до 22%) порівняно з контролем.
Проведені експериментальні дослідження in vitro на семи зразках периферичної крові здорових пацієнтів показали, що застосування НЧ срібла, активованих ППР, призводить до змін функціональної активності клітин крові як нейтрофілів, так і Т-лімфоцитів [2].
Наступним завданням було з'ясувати, як працюватиме інстиляція наночастинок срібла у кров хворого пацієнта. Як об'єкт дослідження in vitro було обрано найбільш численну субпопуляцію лейкоцитів, які
становлять першу лінію захисту вродженої ланки імунної системи – нейтрофільні гранулоцити крові.
Відбиралась кров у 9 пацієнтів з онкологічним захворюванням ока (увенальна меланома). Приготування об'єкту дослідження – нейтрофілів - і подальша робота з ним проводилась за вищезгаданою методикою [1] з тією відмінністю, що замість еритроцитів барана у лунки з нейтрофілами закапували моноклональні антитіла - CD маркери (про них нижче). В якості фермента для візуаліації при мікроскопуванні (збільшення 400х15), застосовувалась пероксидаза хрону. Для опромінювання УФ світлом нейтрофілів з наночастинками срібла було виготовлено спеціальне пристосування до ПЛР 96- луночного серологічного планшету (захищено патентім (3) . Використовувались ультрафіолетові світлодіоди LED-3W-BLUE. Реєстрована потужність випромінювання кожного світлодіода становила – 0,6 Вт/см2.
Відомо, що нейтрофіли в крові здорової людини руйнують мікроби, різні токсини і віруси в основному за рахунок фагоцитозу (виявляють т.зв. фенотип 1). У патологічних ситуаціях нейтрофіли, крім цієї класичної ролі, реалізують не тільки фагоцитарну, але й інші функції, а саме функцію накопичення нейтрофілів і грають пропухлинну роль. Тут з'являється інший фенотип клітини (фенотип 2).Тобто нейтрофільна клітина, пов'язана з пухлинною, сприяють проліферації пухлини. Така клітина називається пухлиннофільтруючою . Для з'ясування специфіки та ролі у цій ситуації нейтрофільної клітини застосовувалися молекулярні моноклональні антитіла – кластери диференціювання т.зв. CD - маркери У нашому випадку використовувався CD-15 маркер. який є маркером адгезії, міграції та протекції пухлинної клітини. Зазначаючи рівень експресії такого маркера, можна судити про онкогенез пухлинної клітини.
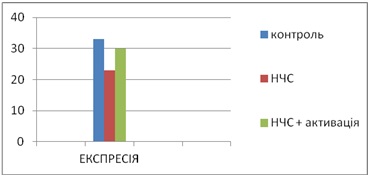
Вимірювання експресії проводилися мікроскопуванням. Вважалися клітини експресованих антигеном в полі зору мікроскопа, які виявлялися при застосуванні візуалізації ферменту (пероксидаза хрону). При цьому на краю цитоплазми фіксувався темний обідок коричневого кольору. На рис.5 видно, що контрольне значення у пацієнтів хворих на меланому складає високий рівень (35,2±6,4%) експресії CD-15 на нейтрофіли (у крові здорових пацієнтів цей показник дорівнює 10,0±4,0%), Після інстоляції наночастинок срібла рівень експресії маркера активації CD-15 значно знизився порівняно з контролем і становив 23,0±3,8%. При обробці зразків УФ світлом при прояві плазмонного резонансу в наночастинках срібла рівень експресії CD-15 на нейтрофілах також знизився порівняно з контролем і становив 29,5±7,5%.
Рис. 5. Експресія маркера активації CD-15 нейтрофіла
Висновки
1. Додавання срібла в кров призводить до помітного розширення смуги діапазону поглинання, що може бути викликане наявністю плазмонного резонансу.
2. Проведені експериментальні дослідження in vitro показали значне збільшення (до 37%) фагоцитарної активності нейтрофілів після поєднаного впливу НЧС та опромінювання нейтрофілів порівняно з контролем.
3. Відзначено значне збільшення реакції розеткоутворення лімфоцитів при впливі НЧС, а також при поєднаному впливі НЧС та опромінюванням порівняно з контролем (до 22%).
4. При патологічних станах нейтрофіли реалізують не лише фагоцитарну, а ще й інші функції (відмічається фенотип 2), при цьому експресують активаційні маркери, які асоціюються з найгіршим прогнозом для пацієнтів з онкологічними захворюваннями.
5. Внаслідок впливу in vitro на активовані нейтрофіли наночастинок срібла, відзначено значне зниження (до 23%) рівня експресії маркера активації нейтрофілів СD 15. (Можна припустити: «у нейтрофілів частково змінюється фенотип 2 на фенотип 1»).
6. Різний ступінь зниження активації нейтрофілів при культивуванні з наночастинками срібла та за допомогою плазмонного резонансу дозволяє модулювати зниження експресії маркера активації нейтрофілів CD-15 (від 33,4% до 13%) з більшою чи меншою мірою.
Література
1. Методические рекомендации. Ускоренная первичная оценка иммунологического статуса человека. НИИ глазных болезней и тканевой терапии им. Акад.. В.П. Филатова. Одесса. 1990г.
2. Ульянов В.О., Скобєєва В.М., Ткаченко В.Г., Макарова М.Б., Величко Л.М., Богданова О. В., Горліцина О.О. Спосіб оцінки впливу наночастинок металів, активованих плазмонним резонансом на функціональну активність клітин крові. Патент на корисну модель. u 2018 00468, від 25.06.2018, Бюл. №12.
3. Макарова М.Б., Ткаченко В.Г.та інш. Пристрій до серологічного планшету для опромінення біоматеріалу різного походження Патент на корисну модель № 154264 від 25.10.2023
|