Вода є основним елементом організму, і доки населення світу зростає на 1,1% на рік, очікується збільшення потреби у споживанні води, у тому числі споживання природної мінеральної води (МВ). На сьогоднішній день спостерігається різке зростання споживання МВ, і найближчими роками тенденція до зростання тільки збільшиться [1]. Споживання води, особливо МВ, відіграє істотну роль у здоров'ї людини, крім того, вона використовується в лікувальних цілях у різних формах та видах [2 - 5]. Наразі питанню безпеки фасованих природних МВ приділяють значну увагу, оскільки щороку збільшується її споживання, і як будь-який інший продукт, вживаний людиною, вона має бути безпечною. Дослідження попередніх років підтверджують важливість постійного моніторингу санітарно-мікробіологічного стану фасованих МВ [6, 7]. Фасована природна МВ має проходити систематичну перевірку на відповідність санітарно-гігієнічного стану, а, зокрема, санітарно-мікробіологічний контроль. МВ, які використовуються при промисловому фасуванні повинні відповідати вимогам ДСТУ 878-93: “Води мінеральні фасовані. Технічні умови” та загальним вимогам Directive 2009/54/EC of the European Parliament and of the Council з експлуатації та маркетингу натуральних МВ.
Технології, що застосовуються при фасуванні природних мінеральних вод, необхідні для стабілізації їх фізико-хімічного складу та мікробіологічного стану безпеки, але крім того МВ мають у своєму складі компоненти, що сприяють природному очищенню. Це деякі біологічно активні сполуки у певній концентрації – ортоборна (Н3ВО3) та метакремнієва (H2SiO3) кислоти. Також важливу роль відіграє наявність автохтонної мікробіоти МВ [8].
Враховуючи вищенаведене мета роботи - проаналізувати вплив специфічних біологічно активних компонентів (ортоборної та метакремнієвої кислот) на мікробіологічний стан фасованих газованих і негазованих мінеральних природних столових і лікувально-столових вод.
Матеріали та методи досліджень. Для визначення кількості коліформних бактерій (КБ) зразки відповідних МВ висіювали на рідке глюкозо-пептонне середовище, а на наступному етапі – середовище Ендо. Колонії отримані на середовищі Ендо засівали уколом у напіврідке глюкозо-пептоне середовище, визначали наявність оксидази та проводили мікроскопію. Кількість сапрофітних мікроорганізмів, як загальне мікробне число, визначали на поживному агарі при 37°С протягом 24 годин. Для визначення Pseudomonas aeruginosa, як середовище накопичення, використовувалося рідке глюкозо-пептоне середовище (ГПС), далі культивація проводилась на середовищі для виділення псевдомонад з додаванням N-цетилпіридинію хлориду (ЦПХ агар), при 37°С 24-48 годин. Отримані колонії продовжували культивувати на середовищі Кінг-А, а також на поживному агарі при 42°С та 4°С і на заключному етапі проводили оксидазний тест та мікроскопію. Для визначення оксидації та ферментації використано середовище Хью-Лейфсона.
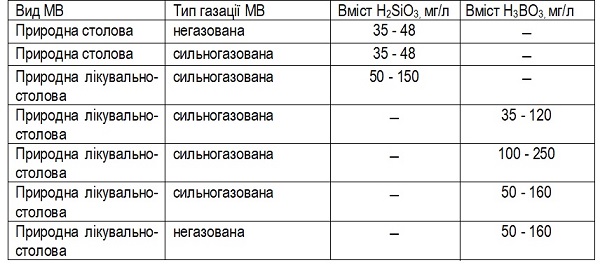
У дослідженні застосовували 6 представників природних фасованих столових та лікувально-столових МВ, які відрізнялись кількісним вмістом ортоборної та метакремнієвої кислот та насиченням СО2.
Таблиця 1.
Результати та їх обговорення. МВ, що містять Н3ВО3 і СО2, були визначені як безпечні за досліджуваними показниками, за винятком МВ, що містить Н3ВО3 в концентраціях 50 мг/л - 160 мг/л без додавання СО2. Було визначено наявність КБ у кількості 9 бактеріальних клітин на 1 л МВ. В інших видах МВ, що містять Н3ВО3, спостерігалося наявність мікроорганізмів при визначенні загального мікробного числа в межах норми, в середньому 1-10 КУО/мл. Визначення наявності деякої кількості непатогенних мікроорганізмів свідчить про те, що навіть МВ з бактерицидним компонентом має власну мікробіоту, яка пристосувалася до існування в даному середовищі.
У ході дослідження, у зразках, що містять низькі концентрації H2SiO3 (35-48 мг/л), було визначено наявність КБ і P. аeruginosa, навіть у зразках, що містять СО2. У мінеральній лікувально-столовій воді, що містить H2SiO3 в концентраціях 50-150 мг/л також було виявлено наявність санітарно-показових мікроорганізмів, хоча й у меншій концентрації та з меншою частотою. Це свідчить, що СО2 не гарантує мікробіологічну безпеку вод. Хоча він і впливає на деякі ферментативні та біохімічні реакції, але все одно, відбувається лише уповільнення швидкості росту бактерій, а не повне його припинення.
У МВ визначалася деяка кількість сапрофітних мікроорганізмів при визначенні загального мікробного числа (ЗМЧ), у разі вод, що містять H2SiO3 в концентраціях 35-48 мг/л, кількість колоній варіювала від 1 до 25 КУО/мл, що свідчить про наявність аутохтонної мікробіоти. Вплив такого фактору як аутохтонна мікробіота досі знаходиться в активному вивченні. Так, як для точного визначення її здатності до антибактеріальної дії недостатньо вивчити всі можливі способи впливу кожного з видів мікроорганізмів аутохтонної мікробіоти, тому що потрібно враховувати їх міжвидові взаємодії. У досліджених типів вод аутохтонну мікробіоту можна вважати не прямим антибактеріальним фактором, а супутнім. Оскільки представники аутохтонної мікробіоти є природними мешканцями цих МВ, вони мають механізми, які допомагають виживати в середовищі. У той час як представники КБ і P. aeruginosa, що потрапили ззовні, таких механізмів не мають.
Висновки. Таким чином, наявність у складі МВ ортоборної кислоти в концентрації 35 мг/л - 250 мг/л обумовлює бактерицидну дію МВ у всіх випадках. Без додавання СО2 бактерицидна дія цих мінеральних природних фасованих вод знижується. При концентрації метакремнієвої кислоти у складі МВ від 35 мг/л до 48 мг/л, не має антибактеріальних властивостей, навіть у поєднанні з діоксидом вуглецю, а при концентрації від 50 мг/л до 100 мг/л має бактеріцидну дію, впливаючи на утворення бактеріальних угруповань. Тобто, ортоборна кислота і метакремнієва кислота в поєднанні з СО2 посилюють антибактеріальну дію один одного.
Список використаних джерел:
1. Bodor K, Bodor Z, Szép A,Szép R. Classification and hierarchical cluster analysis of principal Romanian bottled mineral waters. Journal of Food Composition and Analysis. 2021;100,103903. https://doi.org/10.1016/j.jfca.2021.103903
2. Quattrini S, Pampaloni B, Brandi ML. Natural mineral waters: chemical characteristics and health effects. Clin Cases Miner Bone Metab. 2016;13(3):173- 180. DOI: 10.11138/ccmbm/2016.13.3.173
3. Gushcha S, Dragomiretska N, Zabolotna , Nasibullin B, Izha A, Вadiuk N, Koieva K. Possibilities of using natural mineral waters in the treatment of patients with non-alcoholic fatty liver disease. Balneo Research Journal. 2019;10(4):450-456. DOI: 10.12680/balneo.2019.280
4. Dore MP, Pes GM, Realdi G. Health properties of the Italian San Martino® mineral-rich water: A self-controlled pilot study. Biomed Pharmacother. 2021 Jun;138:111509. doi: 10.1016/j.biopha.2021.111509
5. Manoj S, Kartheeshwari MR, Keerthan L, Elango L. Effects of low mineral content in bottled drinking water on human health and evaluation of optimal requirements. Journal of Food Composition and Analysis. 2024;128:106052. doi: https://doi.org/10.1016/j.jfca.2024.106052
6. Природні лікувальні ресурси: абетка для користувача: інформаційно-аналітичний довідник / Бабов К.Д., Безверхнюк Т.М., Гуща С.Г., Заболотна І.Б., Кисилевська А.Ю., Коєва Х.О., Погребний А.Л., Цуркан О.І..: ДУ «Український НДІ медичної реабілітації та курортології МОЗ України». – «Поліграф»: Одеса, 2021. 76 с.
7. Leclerc H, Moreau A. Microbiological safety of natural mineral water. FEMS Microbiol Rev. 2002 Jun;26(2):207-22. doi: 10.1111/j.1574-6976.2002.tb00611.x 8. Роль мікробіоти у фомуванні мінеральних природних вод / За ред. К.Д. Бабова, О.М. Нікіпелової, А.В. Мокієнка. Одеса, 2017. 240 с.
|